UNIDAD 7. Calor
¡Qué calor!
“Según los científicos, si no reducimos las emisiones de dióxido de carbono, la temperatura media del planeta podría subir
entre 3 y 9 grados a final de siglo
”
Al Gore
7.1. Conceptos previos
- La medida.
- Energía y sus unidades.
- Trabajo.
7.2. Objetivos
- Que el/la alumno/a conozca el concepto de temperatura.
- Que el/la alumno/a comprenda el concepto de agitación térmica asociado a la temperatura de un cuerpo.
- Que el/la alumno/a conozca el concepto de calor.
- Que el/la alumno/a comprenda el concepto de equilibrio térmico.
- Que el/la alumno/a comprenda el funcionamiento de un termómetro.
- Que el/la alumno/a conozca los conceptos de calor específico y calor latente.
- Que el/la alumno/a comprenda los fenómenos de transferencia de energía: conducción, convección y radiación.
7.3. Criterios de Evaluación
|
|
1
|
2
|
3
|
4
|
5
|
|
Tema I. Calor
|
|
|
1. Puedo explicar el concepto de temperatura.
|
|
|
|
|
|
|
2. Puedo explicar el concepto de agitación térmica.
|
|
|
|
|
|
|
3. Puedo explicar el concepto de calor.
|
|
|
|
|
|
|
4. Puedo explicar el concepto de equilibrio térmico.
|
|
|
|
|
|
|
5. Puedo relacionar el funcionamiento de un termómetro.
|
|
|
|
|
|
|
6. Puedo definir el concepto de calor específico.
|
|
|
|
|
|
|
7. Puedo explicar qué es el calor latente de cambio de estado.
|
|
|
|
|
|
|
8. Puedo definir el concepto de conducción.
|
|
|
|
|
|
|
9. Puedo definir el concepto de convección.
|
|
|
|
|
|
|
10. Puedo definir el concepto de radiación.
|
|
|
|
|
|
7.4. Materiales
Objetos cotidianos. Termómetro de mercurio, hielo, agua, varilla metálica, varilla de madera, vela, cerillas.
7.5. Explicación
¡Qué calor!
En la unidad anterior hemos visto que el trabajo es un mecanismo de transferencia de energía entre dos cuerpos o sistemas. A lo largo de esta unidad descubriremos que no es el único.
¡Agitación!
Ya hemos hablado de un modelo muy utilizado para representar la estructura de la materia: la teoría cinética. Según este modelo, la materia está formada por partículas rígidas, con mayor o menor grado de movimiento.
Si tuviéramos una lupa que nos permitiese ver la composición de la materia, al situarla sobre un cuerpo, lo que veríamos sería que está formada por pequeñas esferas rígidas.

Una lupa potentísima (¡más bien un microscopio!) nos permitiría ver la estructura de la materia.
Pero estas esferas no están quietas en su posición, sino que se encuentran vibrando constantemente. Como si estuvieran atadas entre sí por diminutos muelles. Por lo tanto, estas partículas que forman la materia poseen energía cinética.
La temperatura de un cuerpo se define precisamente como una magnitud proporcional a la energía cinética media de las partículas que lo forman. Cuanto más rápido están vibrando estas, mayor es su energía cinética y mayor por tanto es la temperatura de ese cuerpo o sistema.
Este movimiento de vibración de la materia se denomina agitación térmica.
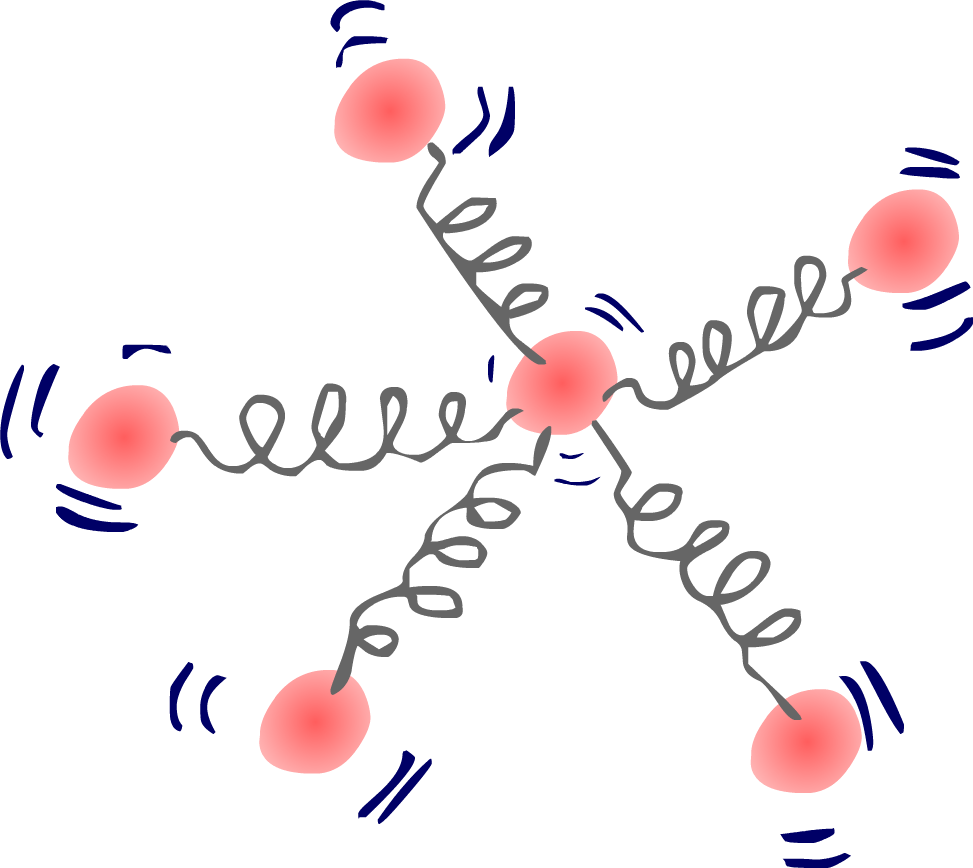
Miles de millones de bolitas unidas por muelles vibrando sin cesar... ¿te lo imaginas?
De esta forma, cuando calentamos por ejemplo una varilla de acero, lo que está ocurriendo es que las partículas de ese sólido están absorbiendo energía y vibrando por tanto con mayor rapidez, o lo que es lo mismo, aumentando su temperatura.
¿Y el calor?
Ahora que ya comprendemos que la temperatura de un cuerpo es una medida de la agitación térmica de las partículas que lo forman, nos resultará sencillo imaginar qué es lo que ocurre cuando ponemos en contacto dos cuerpos que se encuentran a distinta temperatura.
Las partículas del cuerpo que se encuentra a mayor temperatura, golpean con más energía a las del que se encuentra a menor temperatura. Esto produce un intercambio energético que se va propagando a lo largo de las dimensiones del objeto.
Precisamente a este mecanismo de transferencia de energía es a lo que llamamos calor. Como es lógico, su unidad en el Sistema Internacional es el julio.
Vemos también que esta transferencia de energía se producirá desde el cuerpo a mayor temperatura hacia el cuerpo a menor temperatura; y cesará cuando se hayan igualado las temperaturas. Esta situación se llama equilibrio térmico.
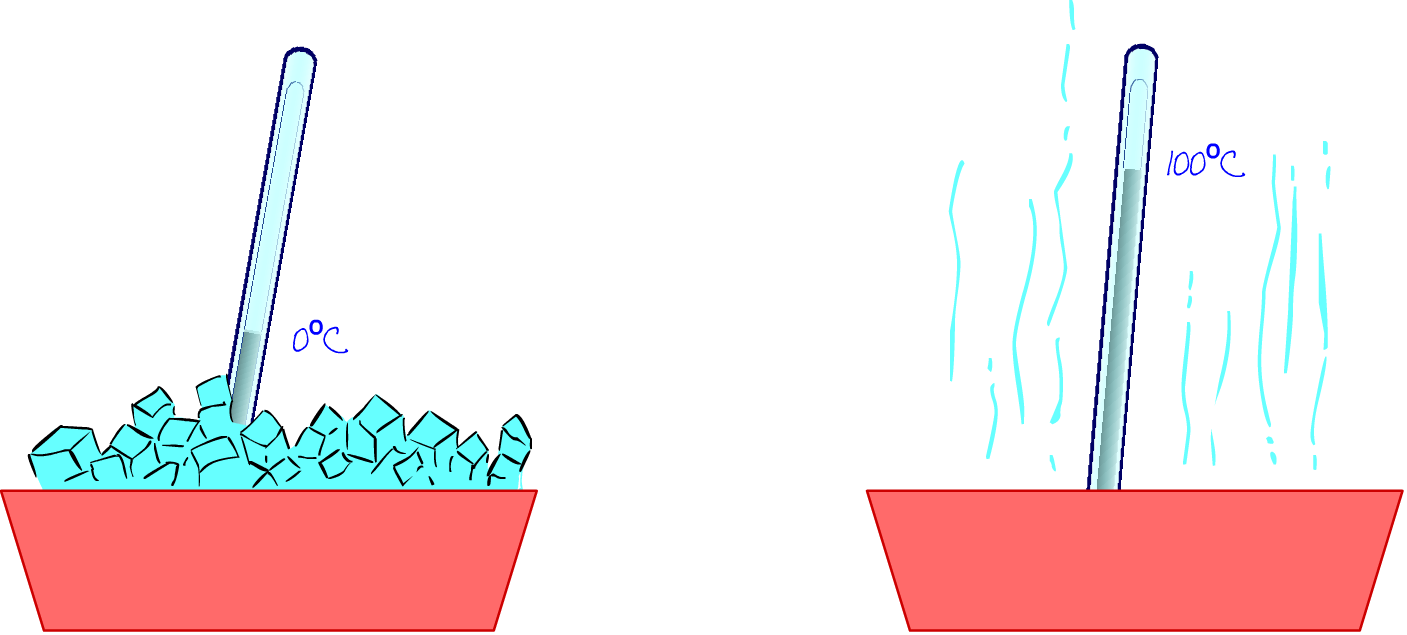
Ahora que ya conocemos cómo se produce este mecanismo de transferencia de energía entre dos cuerpos a través de calor, vamos a construir un dispositivo que nos permita medir temperaturas: un termómetro. Si queremos definir una escala decimal o centígrada, necesitamos un punto donde situar el 0 y otro punto donde situar el 10 o el 100.
Vamos a construir una escala centígrada.
Asignamos, por ejemplo, el 0 de dicha escala al punto de fusión del hielo, en condiciones normales (25º C de temperatura y una atmósfera de presión); y situamos el 100 de dicha escala en el punto de ebullición del agua. Ahora solo necesitamos “algo”, una magnitud, que varíe con la temperatura. Pensamos en una columna de mercurio o de alcohol. Cuando aumenta la temperatura se dilata y aumenta su longitud y se contrae cuando la temperatura disminuye. Introducir alcohol en un capilar de vidrio nos puede servir como instrumento de medida de temperaturas.
Este dispositivo lo introducimos º en hielo fundente y asignamos 0 grados centígrados (0º C) al punto donde se encuentra el nivel de mercurio; ponemos agua a hervir, introducimos nuestro dispositivo en el agua, y asignamos el valor 100 grados centígrados (100º C) a la posición que alcanza el nivel de mercurio. Solo tendremos que dividir en cien unidades la longitud del capilar y ya tendremos construido nuestro termómetro.
En la actualidad los termómetros de mercurio están siendo retirados debido a que son altamente contaminantes para el entorno. ¡Investiga en qué propiedades se basa el funcionamiento de los nuevos termómetros!
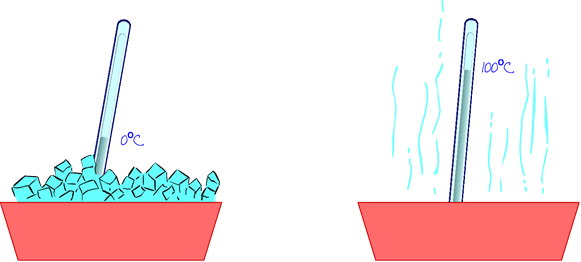
¿Serías capaz de definir tu propia escala de temperaturas?
Hablemos de cantidades
Pero… ¿de qué depende la cantidad de calor que es capaz de absorber o ceder un cuerpo?
Vamos a imaginarnos (o a experimentar ¡con precaución!), que ponemos a calentar cierta cantidad de agua en una cazuela.
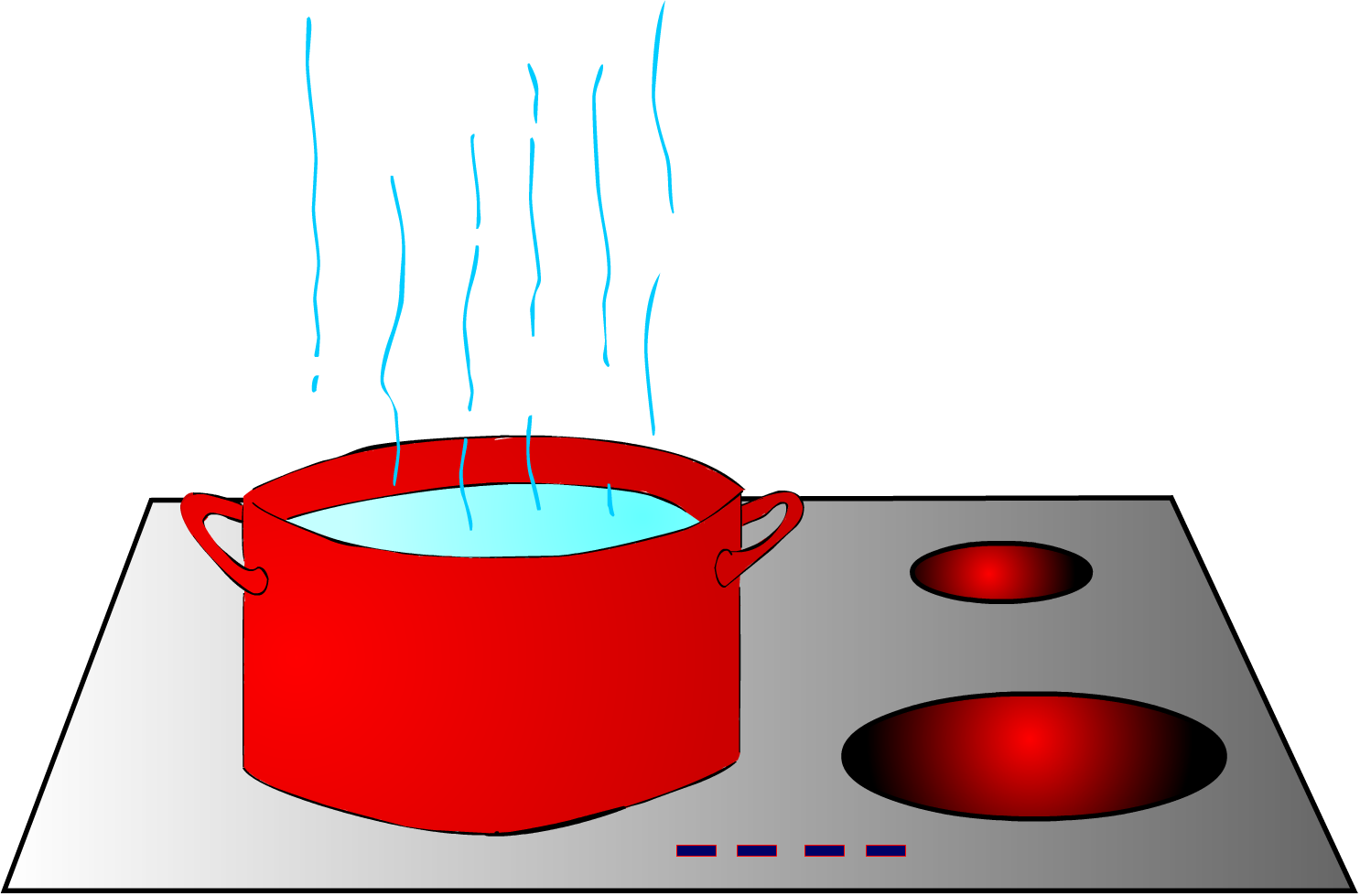
Al poner el agua a calentar, iniciamos un proceso de transferencia de energía a través de calor.
Obviamente, para calentar el agua hasta 100º C, necesitamos comunicar más energía que para elevar su temperatura hasta 50º C. Por tanto, la cantidad de energía que absorbe el agua a través de calor, depende de la cantidad en que varía su temperatura. También es evidente que depende de la cantidad de agua que quiero calentar, es decir, de su masa.
Pero si tomáramos masas iguales de distintas sustancias y quisiéramos provocarles un mismo aumento de temperatura, necesitaríamos cantidades distintas de energía.
Esto nos hace interesante definir el calor específico: la energía que absorbe un cuerpo de masa unidad cuando su temperatura aumenta 1º C.
Resumiendo, la cantidad de energía que absorbe un cuerpo cuando aumenta su temperatura depende de: la masa de la sustancia, el tipo de sustancia (su calor específico) y lo que varía su temperatura.
Pero siempre que un cuerpo absorbe energía, ¿aumenta su temperatura?
Retomemos nuestra cazuela, pero esta vez vamos a llenarla de hielo, introducimos un termómetro y la ponemos a calentar.
Si el hielo lo acabamos de sacar del congelador, quizá a unos -18º C, la energía que va absorbiendo, la está empleando el hielo en aumentar su temperatura, como ya hemos comentado.

Nuestra experiencia comienza poniendo hielo en una cazuela y calentándolo.
Pero cuando llega a 0º C, ¿qué ocurre? Quizá para apreciarlo debamos poner los fogones al mínimo, para que el proceso se produzca lentamente y nos dé tiempo a observar.
Veremos que a 0º C, el hielo comienza a fundirse. El hielo no sobrepasa los 0º C, sin embargo está absorbiendo energía. ¿En qué emplea esa energía?
Esa energía es absorbida por las moléculas de agua, que cada vez vibran más rápidamente. Esta energía de vibración termina por ser mayor que la energía que las mantiene ligadas, en estado sólido, y hace que pasen a estado líquido. Este razonamiento podemos aplicarlo también a la transición de líquido a gas.
Dependiendo de la sustancia de la que hablemos, necesitaremos más o menos energía para hacer cambiar de estado a una determinada cantidad de la misma.
La energía que absorbe una unidad de masa de una sustancia cuando cambia de estado, se denomina calor latente de cambio de estado.
¡Energía va!
Como indicábamos en la unidad anterior, una de las propiedades de la energía es que se puede transferir de unos sistemas a otros.
Ahora nos preguntamos, ¿cómo puede producirse un intercambio de energía entre dos cuerpos debido al hecho de que se encuentran a distinta temperatura?
Enseguida se nos ocurre imaginar, y de alguna forma ya lo hemos descrito, que si acercamos un objeto metálico, por ejemplo una aguja, a la llama de una vela, ¡casi inmediatamente nos quemamos!
La forma en que se ha producido la transferencia de energía ha sido descrita en un apartado anterior: las partículas de la punta de la aguja son golpeadas por las partículas procedentes de la combustión de la vela, y golpean a su vez a sus vecinas, y así se va propagando la energía a través de la aguja hasta el otro extremo. Este mecanismo de transferencia de energía a través de calor se llama conducción.
Algo distinto observaremos si ponemos una cazuela con agua en el fogón de nuestra cocina. Cuando el agua empieza a hervir, observamos un movimiento turbulento dentro de la cazuela. ¿Qué está ocurriendo?
El agua que está en contacto con el fondo de la cazuela se calienta antes que el resto. Al calentarse se dilata, ocupa más volumen, o lo que es lo mismo, disminuye su densidad. El agua caliente se vuelve más ligera que el resto del agua, pesa menos, y por tanto comienza a ascender, pasando a ocupar su lugar una masa de agua que está a menor temperatura. Este movimiento del agua debido a la diferencia de temperaturas recibe el nombre de corrientes convectivas, y a este mecanismo de transferencia de energía, que implica movimiento de masa, convección. ¿Te atreves a buscar otras situaciones en las que se produzcan corrientes convectivas?
Y por último, si pensamos en la energía que diariamente recibimos del Sol, y cómo nos llega esta energía, concluiríamos que es a través de la luz. La energía del Sol se transmite por radiación. En la Unidad 10 hablaremos de la luz con más amplitud.
7.6. Actividades de generalización
Los alumnos prepararán una presentación (utilizando como herramientas PowerPoint o Prezzi, por ejemplo) en la que plasmarán las ideas principales expuestas buscando imágenes en Internet o creando sus propias imágenes. Cada alumno expondrá al resto del grupo su presentación. Los demás alumnos aportarán sugerencias y rectificarán posibles errores con ayuda del profesor.
Durante la exposición, los alumnos utilizarán sus propios ejemplos y modelos para representar las interacciones.






